A fisiologia da obesidade em gatos e cachorros

Links rápidos:
A quantidade de gordura corporal está associada ao balanço entre a ingestão (alimentação) e o gasto energético (metabolismo e atividade física), resultando em homeostase para a manutenção de peso. O principal órgão envolvido nesta regulação é o cérebro, apesar da participação de sinais nervosos provenientes da massa gorda (sinais da adiposidade) e informações provenientes do sistema gastrointestinal (sinais de saciedade) (WOODS; SEELEY, 2002).
O tecido adiposo libera sinais para o hipotálamo. Sinais também são liberados pelo sistema gastrointestinal e pelo fígado, informando sobre o alimento consumido, o sabor, distensão estomacal e conteúdo do alimento. Os sinais de saciedade são enviados para o cérebro que responde por meio da liberação de neuropeptídios que controlarão a ingestão e o gasto energético (SCHWARTZ et al., 2000).
Inicialmente o apetite e a ingestão de alimento são controlados por sinais hormonais e metabólicos, como por exemplo a queda na concentração de glicose no sangue (WOODS; SEELEY, 2002). Sob circunstâncias normais, o ato de comer também está associado ao ambiente, interações sociais e comportamentos aprendidos (REDINGER, 2007).
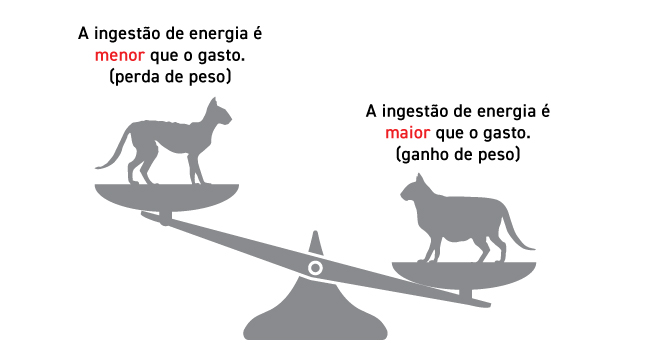
Figura 1. Equilíbrio entre ingestão e gasto de energia (GERMAN; BUTTERWICK, 2010)
Sinais fisiológicos e ambientais estão relacionados com o início e o término de uma refeição. Mecanismos recentes descrevem que um peptídeo gastrointestinal, chamado colecistoquinina (CCK), envia informações para o cérebro avisando a quantidade de alimento ingerida e quantas calorias foram acumuladas, promovendo então a sensação de saciedade. A colecistoquinina é secretada à medida que as calorias são ingeridas. A grelina, peptídeo produzido principalmente pelas células do estômago, é conhecida como o “hormônio da fome” e é secretada imediatamente antes de uma refeição (CARCIOFI, 2005).
Hormônios produzidos pelo tecido adiposo, como a leptina, também funcionam como estímulos para o controle de ingestão energética. A leptina é uma adipocina sintetizada pelo tecido adiposo como resposta do aumento da insulina pós-prandial. Ela atua no controle de peso dos animais por meio da ativação do centro hipotalâmico da saciedade e pela elevação da termogênese (WOODS; SEELEY, 2002). Alguns estudos defendem que animais obesos apresentam resistência à leptina, diminuindo sua atuação e colaborando para a obesidade (ZHANG et al., 2014).
Atualmente, a obesidade é compreendida como um estado inflamatório de baixa intensidade, uma vez que o tecido adiposo é capaz de produzir citocinas que resultam em inflamação. Entre as principais citocinas produzidas temos o fator de necrose tumoral (TNFα) e a IL-6, envolvidos também na resistência insulínica (GAYET et al., 2004; QATANANI; A.LAZAR, 2007).
Indivíduos obesos secretam mais insulina e leptina, sendo a secreção dependente do teor de tecido adiposo corporal (POLONSKY; GIVEN; VAN CAUTER, 1988) . Apesar desta maior produção hormonal, o indivíduo obeso apresenta menor sensibilidade a estes neuropeptídios, fazendo com que haja aumento da ingestão de alimento, diminuição do gasto energético e aumento do peso corporal, em um desbalanço energético e falta de regulação deste mecanismo (WOODS; SEELEY, 2002).
Referências bibliográficas
CARCIOFI, A. C. Obesidade e suas conseqüências metabólicas e inflamatórias em cães e gatos. , 2005.
GAYET, C. et al. Insulin resistance and changes in plasma concentration of TNFalpha, IGF1, and NEFA in dogs during weight gain and obesity. , v. 88, n. 3–4, p. 157–165, 2004.
GERMAN, A.; BUTTERWICK, R. Livro de bolso do WALTHAM ® sobre manutenção do peso saudável para cães e gatos. p. 8–9, 2010.
POLONSKY, K. S.; GIVEN, B. D.; VAN CAUTER, E. Twenty-four-hour profiles and pulsatile patterns of insulin secretion in normal and obese subjects. , v. 81, n. 2, p. 442–448, 1988.
QATANANI, M.; A.LAZAR, M. Machanisms of obesity-associated insulin resistance : many choice on the menu. , n. 215, p. 14, 2007.
REDINGER, R. N. The pathophysiology of obesity and its clinical manifestations. , v. 3, n. 11, p. 856–863, 2007.
SCHWARTZ, M. W. et al. Central nervous system control of food intake. , v. 404, n. 6778, p. 661–671, 2000.
WOODS, S. C.; SEELEY, R. J. Understanding the physiology of obesity: Review of recent developments in obesity research. , v. 26, p. S8–S10, 2002.
ZHANG, Y. et al. Obesity: Pathophysiology and intervention. , v. 6, n. 11, p. 5153–5183, 2014.