Tratamento da doença inflamatória intestinal canina

Links rápidos:
Introdução
Doença Inflamatória Intestinal (DII) é o termo aplicado a um grupo de doenças intestinais crônicas (enteropatias), caracterizado por sinais gastrintestinais (GI) persistentes ou recorrentes e inflamação do trato GI. A enteropatia inflamatória envolve uma interação complexa entre a genética do hospedeiro, o microambiente intestinal (principalmente bactérias e constituintes da dieta), o sistema imunológico e os “deflagradores” ambientais de inflamação intestinal.
As etapas específicas que levam à DII, bem como as bases de variação fenotípica e as respostas imprevisíveis ao tratamento, não são conhecidas.
O presente artigo concentra-se no tratamento de cães com DII, embora este seja influenciado pelo tipo de enteropatia inflamatória e guiado por fatores como predisposição racial, gravidade dos achados clínicos e clinicopatológicos, além dos aspectos macro e microscópico (histopatológico) dos intestinos.
Diagnóstico e fenotipagem da doença inflamatória intestinal
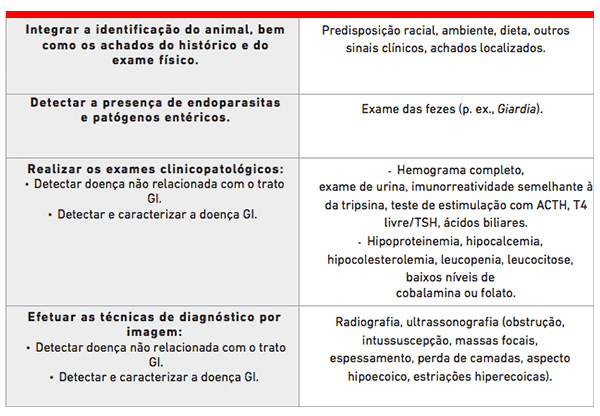
O diagnóstico da DII costuma envolver uma integração meticulosa de fatores como a identificação do animal, o ambiente em que ele vive, os achados do histórico e do exame físico, os testes clinicopatológicos, as técnicas de diagnóstico por imagem e a histopatologia de biópsias intestinais.
Predisposição racial
A predisposição de certas raças de cães à enteropatia inflamatória apoia fortemente um papel desempenhado pela genética do hospedeiro (Tabela 1), embora os defeitos genéticos causais ainda não tenham sido identificados até o momento. Essa predisposição racial (p. ex., Boxer, Buldogue Francês e Pastor Alemão), juntamente com a resposta clínica a antibióticos, aponta para uma interação entre a suscetibilidade do hospedeiro e a microbiota (2-5). Nas raças Boxer e Buldogue Francês com colite granulomatosa, a remissão duradoura se correlaciona com a erradicação da E. coli invasiva na mucosa, semelhante às cepas isoladas da Doença de Crohn (4). Estudos em cães da raça Pastor Alemão identificaram polimorfismos em fatores relacionados com a imunidade inata: os receptores Toll-like (TRLs), que sofrem segregação em casos de doença. Foi demonstrado que esses cães possuem uma expressão aumentada de TLR2 e diminuída de TLR5 quando comparados com Greyhounds saudáveis (6).
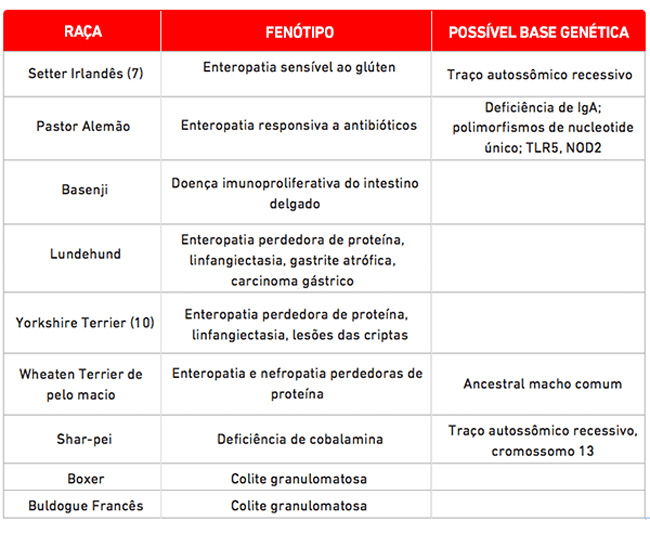
A suspeita de uma interação entre fatores genéticos e a dieta em cães é apoiada pela descoberta de que a enteropatia sensível ao glúten em cães da raça Setter Irlandês é um traço autossômico recessivo, embora a mutação causal não tenha sido identificada (7). Reações adversas a alimentos também são descritas em Wheaten Terriers de pelo macio acometidos pela síndrome de enteropatia e nefropatia, ambas com perda de proteína (8). A análise do pedigree demonstrou um ancestral macho comum, apesar de o modo de herança ser desconhecido.
Avaliação clínica
Os cães com DII são tipicamente levados à consulta para investigação de diarreia, perda de peso ou vômito. A abordagem inicial é feita com base na determinação da natureza e da gravidade do quadro, bem como nos achados clínicos específicos ou localizados. O início dos sinais clínicos adicionais frequentemente aponta para a causa subjacente; p. ex., tenesmo e disquezia sugerem doença do intestino grosso; melena é sinal sugestivo de sangramento ou ulceração do trato GI superior; distensão abdominal, dispneia ou edema periférico sugerem perda de proteínas entéricas.
Nos casos em que há diarreia, essas informações são integradas para determinar se ela é atribuível à doença do intestino grosso (caracterizada por disquezia, tenesmo, aumento na frequência de defecação e pequeno volume de fezes com muco e sangue) ou é uma consequência de doença do intestino delgado ou de insuficiência pancreática exócrina (caracterizada por grandes volumes de diarreia, perda de peso e possível vômito). Em pacientes com dor abdominal, desidratação, vômito frequente ou achados localizados (p. ex., massa abdominal), esses problemas são pesquisados antes de qualquer avaliação diagnóstica mais aprofundada de diarreia crônica. Em pacientes com diarreia sem nenhuma causa óbvia, é melhor adotar uma abordagem sistemática determinada pela localização da diarreia no intestino delgado ou grosso. Os pacientes com sinais de envolvimento tanto do intestino delgado quanto do grosso costumam ser avaliados em busca de doença GI difusa.
Estudos controlados demonstraram que a hipoalbuminemia é associada a um desfecho ruim em cães com enteropatia crônica (9, 10). As concentrações séricas de cobalamina e folato podem ser mensuradas, para determinar se há ou não necessidade de suplementação; baixos níveis de cobalamina (< 200 ng/L) são associados a um prognóstico negativo (9). A avaliação da função hemostática é recomendada, para averiguar se a hipo ou hipercoagulabilidade se desenvolveu secundariamente à perda entérica de proteínas.
Em pacientes estáveis com diarreia crônica (ou seja, com apetite preservado, leve perda de peso, proteínas séricas normais, sem apatia e sem espessamento intestinal ou linfadenopatia) e naqueles com perda de peso indefinida, a mensuração das concentrações séricas de cobalamina e folato pode ajudar a determinar a necessidade de biopsia intestinal, situar o local de acometimento da doença intestinal (p. ex., a cobalamina é absorvida no íleo), definir a necessidade de suplementação de cobalamina e estabelecer um prognóstico. Naqueles com concentrações normais de cobalamina, pode-se fornecer ao proprietário do animal a opção de ensaios terapêuticos empíricos com dieta, acompanhados por antibióticos na ausência de resposta à dieta (ver “enteropatia com alterações mínimas” adiante). A falha de resposta à terapia empírica ou o agravamento da doença é uma indicação para a realização de endoscopia e biópsia do intestino. Em pacientes estáveis com diarreia crônica e cobalamina sérica abaixo do normal, o autor prossegue com a avaliação endoscópica e biópsia intestinal, em vez de ensaios terapêuticos empíricos.
Abordagem diagnóstica inicial da diarreia crônica
Estratégias para ensaios terapêuticos com a dieta

Tratamento
Atividade patológica leve a moderada, histopatologia leve a moderada (linfócitos e plasmócitos constituem os tipos celulares predominantes), albumina sérica > 20 g/L:
• Instituir tratamento empírico contra Giardia e helmintos se esse tratamento já não foi iniciado. Proceder à suplementação de cobalamina e folato se os níveis estiverem abaixo do normal.
Abordagem progressiva:
• Modificar a alimentação em primeiro lugar: dieta hidrolisada ou hipoalergênica restritiva (ou seja, com restrição de antígenos) por 2 semanas; em caso de resposta satisfatória, manter o animal sob a dieta. Considerar o desafio provocativo (reexposição) para confirmar a intolerância alimentar, além de promover o desafio com os ingredientes alimentares isolados para definir os substratos ofensores (agressores).
Na ausência de resposta:
• Administrar antibióticos: p. ex., tilosina por 2 semanas (10-15 mg/kg VO 3 vezes ao dia); em caso de resposta satisfatória, manter o animal sob antibioticoterapia por 28 dias e, depois, interromper.
Na ausência de resposta, prosseguir com a tilosina e então:
• Realizar imunossupressão: p. ex., glicocorticoides (2 mg/kg VO 1 vez ao dia por 21 dias; 1,5 mg/kg VO 1 vez ao dia por 21 dias, 1 mg/kg VO 1 vez ao dia por 21 dias) e/ou azatioprina (2 mg/kg VO 1 vez ao dia por 5 dias, depois 2 mg/kg VO em dias alternados).
• Em caso de resposta insatisfatória, reavaliar o animal antes de se considerar o aumento da imunossupressão (p. ex., ciclosporina a 5 mg/kg VO 1 vez ao dia por 10 semanas). Em caso de resposta satisfatória, reduzir primeiro a imunossupressão gradativamente e, depois, interromper os antibióticos.
Atividade patológica moderada, histopatologia intestinal moderada a grave (atrofia e fusão, com linfócitos e plasmócitos como os tipos celulares predominantes), albumina sérica < 20 g/L:
• Executar tratamento empírico contra Giardia e helmintos se esse tratamento já não foi iniciado. Promover a suplementação de cobalamina e folato se os níveis estiverem abaixo do normal.
Abordagem regressiva:
Efetuar tratamento concomitante com dieta (dieta hidrolisada ou hipoalergênica restritiva), antibióticos (p. ex., tilosina) e imunossupressão (glicocorticoides e/ou azatioprina). O teste alimentar deve aguardar os resultados da biópsia.
• Em caso de resposta insatisfatória, reavaliar todos os achados antes de se considerar o aumento da imunossupressão (p. ex., ciclosporina).
• Pensar na falha de absorção da prednisolona oral e trocar para corticosteroides injetáveis.
• Em pacientes com ascite, pode-se preferir a dexametasona no lugar da prednisolona para evitar o aumento na retenção de líquido.
• Usar terapia concomitante com ácido acetilsalicílico em doses ultrabaixas (0,5 mg/kg 1 vez ao dia) em pacientes considerados sob risco de doença tromboembólica e considerar o uso criterioso de diuréticos (furosemida e espironolactona) naqueles com ascite grave.
• O uso de dietas elementares e de nutrição parenteral parcial pode ser indicado em alguns cães com grave enteropatia perdedora de proteína. Em caso de resposta satisfatória, reduzir primeiro a imunossupressão gradativamente e, depois, interromper os antibióticos.
Considerações finais
O tratamento de enteropatia inflamatória é guiado por fatores como: predisposição racial, gravidade dos achados clínicos e clinicopatológicos e aspectos macro e microscópico (histopatológico) dos intestinos. Cada caso deve ser submetido a uma avaliação diagnóstica sistemática, embora o prognóstico possa ser variável. Contudo, não pode haver dúvida de que, ao longo dos próximos anos, pesquisas contínuas fornecerão conhecimentos mais aprofundados e sugestões terapêuticas mais precisas para os inúmeros animais que se apresentam com sinais semelhantes à doença inflamatória intestinal.